关键词:无菌制剂;配液系统;自动运行
Abstract: According to the requirements of sterile preparations, the automatic dispensing system and CIP station system of Ousirui Technology are systematically introduced. This system can ensure that each production sub-process runs automatically, and the parameters in the production process are monitored and alarmed in real time to ensure the production quality. Combined with the actual production needs, the optimal design meets the needs of various liquid formulations.
Key words: Sterile preparations; Dosing system; Automatic operation
1 前言
无菌制剂[1]是在无菌环境中采用无菌操作方法或技术制备的不含任何活的微生物繁殖体和芽孢的一类药物制剂。无菌操作中的污染主要可分为不可控的活性污染(如存在细菌和病毒等微生物)和可控的非活性污染(如制剂设备等)。所以配液系统成为无菌制剂的重要环节。根据GMP、容器关键区域、洁净区、过滤区等要求,欧思瑞科技为美媛本草提供了无菌制剂的配液系统和CIP站系统解决方案。
该方案成功达到了在操作和维护过程合理的情况下的生产过程高度自动化,在设备设计中符合GMP规范[2-3]和CIP[4]等操作能力,排水、干燥和无菌性要求等均能够达标。系统配备有多通道阀等切换操作,在防止交叉感染的要求下又能够做到操作简便。同时,还有完善的故障诊断和排除机制,确保产品在最大程度上受到保护。
2 需求目标
冻干配液是为了将分散的产品、辅料、溶剂集中起来,可能是简单的液体混合、固体活性物质溶解,也可能是更复杂的操作均质乳化或形成脂质体。影响配液的主要因素有温热性能、主药成分和辅药浓度、成品pH值、配液容器、管道等。美媛本草需要一套能够完成冻干配液系统,包括配置系统和CIP站系统。
配液系统安装和运行需要符合设计要求,资料、文件符合GMP管理要求,配液系统空载、负载情况符合生产要求,生产环境洁净度符合洁净度标准(见表1),生产环境存在的微生物符合微生物检测标准(见表2)。该设备在整个生产过程中用于完成原料药到指定浓度药液的配制,其中包括标准浓度药液的配制、药液pH的调节、药液温度的控制、过滤器无菌过滤、滤液的接收。具有在位清洗系统,根据工艺要求对配液系统及其管道的在位清洗,在清洗过程中罐内无死角。具有在位灭菌系统,配液罐、过滤器、滤液接受器、其他连接部分正压力应按国家标准设计和制造。纯蒸汽灭菌应与配液系统一起在线蒸汽,同时应配有手动用以测试过滤器完整性和有效性。
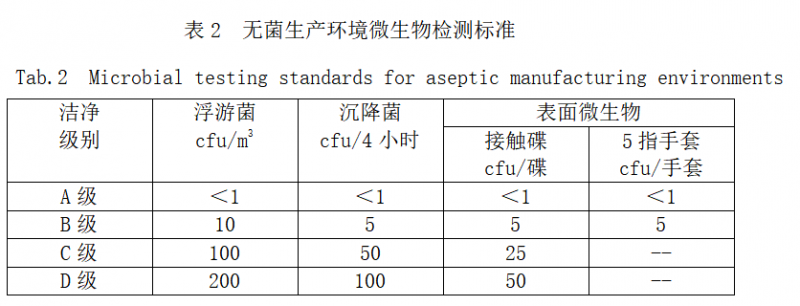
表1 无菌生产环境洁净度标准
Tab.1 Cleanliness standard for aseptic production environment
|
洁净 级别 |
悬浮粒子最大允许数/立方米 |
|||
|
静态 |
动态 |
|||
|
≥0.5μm |
≥5μm |
≥0.5μm |
≥5μm |
|
|
A级 |
3520 |
20 |
3520 |
20 |
|
B级 |
3520 |
29 |
35200 |
2900 |
|
C级 |
35200 |
2900 |
3520000 |
29000 |
|
D级 |
3520000 |
29000 |
-- |
-- |
3 系统建设方案及特点
3.1 系统整体建设方案
该系统需要以SIEMENS公司的S7 1200型号PLC[5]作为主机控制器,SIEMENS ET 200SP分布式远程I/O系统作为数字、模拟量的输入输出。在此框架下,完成冻干配液系统的配置系统(见图1)和CIP站系统(见图2)的设计。
使系统能够用于不同产品的药液配置和过滤,具有搅拌和液体在位称量等功能。系统主要由主机、罐体、磁力搅拌、离心泵、自吸泵、称重、触摸屏等组成,具备CIP功能,CIP站系统由控制系统自动控制,对密闭容器和管道内表面进行清洗和灭菌。
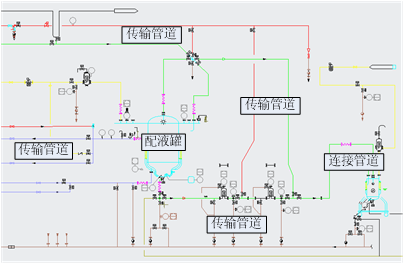
图1 配置系统图
Fig.1 Configuration system diagram
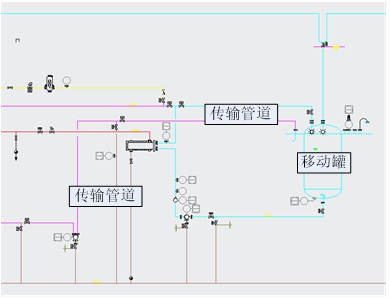
图2 CIP站系统图
Fig.2 CIP station system diagram
3.2 系统的特点
该配液系统具有全自动配液的特点,降低了人工操作的失误可能性,提高生产效率,降低了运营成本,在物料输送的最后阶段,具有独特的自动化执行方案,确保过滤器残留能够完全得到利用。配备的执行程序根据主机PLC的特点完全设置成模块化执行,简单方便,调试改参容易,容错率较高,模块化也为系统拆卸组装提供了便利。
系统实行多阶段完善优化设计,根据客户在不同阶段的不同需求,在设计系统的时候采用分阶段式的设计。基础设计阶段为客户提供方案选择,客户能够根据不同场景需求,如工作场景、工艺性能等,为系统选择总体设计布局。详细设计阶段为客户提供系统分配的设计,如管道布置、阀门采用等,模型效果预览以及自动控制功能的设计。细节设计阶段根据场景的特殊需要以及客户具体要求,完善系统整体的运行质量。
该系统还可以实现多品种自动按配比设置,可降低人工操作失误的风险,使生产流程标准化、自动化。同时,系统能够自动记录运行时间和参数,可主动设置警报信息,符合高标准生产要求。
4 项目验证
欧思瑞针对美媛本草在无菌制剂中的需要,设计了冻干配液系统的配置系统和CIP站系统。系统整体布局图见图3。系统设计完成、执行程序上载完成后,对项目进行测试验证。

图3 配液系统整体设计实际布置图
Fig.3 Overall layout of the dosing system
4.1 供应商内部测试
自查确认配液系统的设计和安装是否符合设计要求,资料、文件是否符合GMP管理要求,系统运行性能是否符合生产要求,计量器具等是否校正准确,公用介质是否连接齐全正确等。所有环节确认完毕后对系统进行测试验证。对系统的负载运行配液系统时的装载量、搅拌、排放等进行验证,结合系统的密封性检查记录、配液罐液位检查记录、搅拌器运行记录等对试验结果及数据进行分析。内部测试图见图4。若与要求存在预期之外的误差,进一步分析、改进系统。

图4 内部测试图
Fig.4 Internal test diagram
4.2 现场安装测试
将系统设备在生产现场完成组装后,按照内部测试的准备工作步骤对系统进行相应的检查。确定所有准备工作完成后开始进行测试。模拟实际生产过程,对配液系统自动控制的流程、罐体及管道铺设、CIP清洗检查验证、灭菌完成度等进行试验。现场测试系统图见图5。根据实际情况,在现场为系统进行程序或参数等调整,使系统尽可能达到最理想的运行状态。
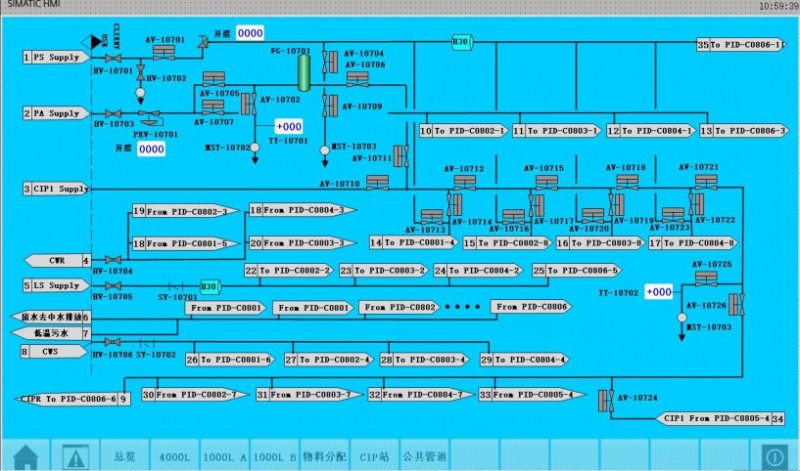
图5 现场测试图
Fig.5 Field test diagram
5 结论
张家港欧思瑞医疗科技有限公司为美媛本草在无菌制剂上设计完成的冻干配液系统的配置系统和CIP站系统成功得到了应用。该套配液系统选用符合FDA和GMP认可的优质材料及配件,降低对药品污染的风险,提高设备运行稳定性及药品生产的无菌水平;具有稳定的产品配制与生产过程;自动控制系统操作简单方便,降低了人工失误的可能性;清洗灭菌程度高、彻底性强;具有完善的设备运行记录、参数记录等;模块化的设计与生产制造,保证了设备的便捷性与制作质量。
参考文献:
[1] 黄燕斌. 无菌制剂生产工艺验证研究[J]. 机电信息, 2018(32):1-9.
[2] 陈佳龙. GMP规范下的某药品生产企业项目设计[D]. 湖北工业大学, 2018.
[3] 石海波. 药品生产质量管理规范(GMP)在我国的实施与展望[J]. 化工管理, 2016(01):153.
[4] 王雨明. 全新节能,高效CIP解决方案[J]. 中国洗涤用品工业, 2014(11):19-23.
[5] SIEMENS. SIMATIC S7 S7-1200可编程控制器系统手册. 2016.







共0条 [查看全部] 网友评论